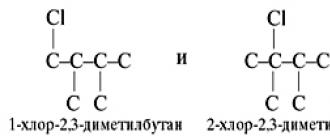Решение качественных задач
в курсе органической химии
Элективный курс 11 класс
Продолжение. См. № 23/2006, 7/2007.
Раздел 2.
Установление структуры веществ
на основе данных физико-химических методов
и химических свойств (продолжение)
Занятие 6. Расчетные задачи
на установление структуры вещества
Ц е л ь. Научить школьников решать расчетные задачи на установление строения вещества.
Задание 1. Установите строение углеводорода, при сгорании одного объема которого образуется шесть объемов углекислого газа, а при хлорировании на свету – только два монохлорпроизводных.
Решение
Схема задачи:
Собственно подсказок для решения задачи две: это выделение шести объемов СО 2 (значит, в молекуле 6 атомов углерода) и то, что хлорирование идет на свету (значит, это алкан).
Формула углеводорода – С 6 Н 14 .
Устанавливаем структуру. Поскольку у этого углеводорода всего два монохлорпроизводных, значит, его углеродная цепь следующая:
Это – 2,3-диметилбутан. Каркасы хлоруглеводородов следующие:

Задание 2. Для сжигания порции алкана, содержащей 1 10 23 молекул, требуется порция кислорода, содержащая 1,6 10 24 атомов. Установите состав и возможное строение (все изомеры) алкана.
Решение
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде (через n ), т.к. без этого задачу не решить:
С n H 2n +2 + (1,5n + 0,5)O 2 = n CO 2 + (n + 1)H 2 O.
(алкана) = 1 10 23 /(6,02 10 23) = 0,166 моль,
(O 2) = 1,6 10 24 /(6,02 10 23 2) = 1,33 моль.
Составим пропорцию:
1 моль алкана – 1,5n + 0,5 кислорода,
0,166 моль алкана – 1,33 моль кислорода.
Отсюда n = 5.
Это – пентан C 5 H 12 , для него возможны три изомера:

Задание 3. Смесь алкана и кислорода, объемное соотношение которых соответствует стехиометрическому, после сгорания, конденсации паров и приведения к исходным условиям сократилась по объему вдвое. Установите строение алкана, входившего в состав смеси.
Решение
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде через n , т.к. без этого задачу не решить:
С n H 2n +2 + (1,5n + 0,5)O 2 = n CO 2 + (n + 1)H 2 O.
До реакции общий объем газов был:
(1 + 1,5n + 0,5) л.
После реакции учитываем только объем СО 2 – n л (вода H 2 O при 20 °С – жидкость).
Составляем уравнение: 1 + 1,5n + 0,5 = 2n .
Отсюда n = 3.
Ответ . Пропан C 3 H 8 .
Задание 4. Смесь алкана и кислорода, объемное соотношение которых соответствует стехиометрическому, после сгорания, конденсации паров воды и приведения к н.у. cократилась по объему в 1,8 раза. Установите формулу алкана, входившего в состав смеси, если известно, что в его молекуле четыре первичных атома углерода.
Ответ . Неопентан (СН 3) 3 ССН 3 .
Задание 5. При пропускании смеси цис- и трансизомеров алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась больше массы исходного алкена. Установите строение алкена.
Решение
Напишем уравнение реакции алкена с раствором перманганата калия:
3С n H 2n + 2KMnO 4 + 4H 2 O = 3С n H 2n (OH) 2 + 2MnO 2 + 2KOH.
Пусть в реакцию вступил 1 моль алкена, тогда выделилось 0,6667 моль оксида марганца(IV).
M r (MnO 2) = 87, m (MnO 2) = 87 0,6667 = 58 г.
Следовательно, учитывая условие задачи, относительная молекулярная масса алкена меньше 58. Этому условию отвечают алкены С 2 Н 4 , С 3 Н 6 , С 4 Н 8 .
По условию задачи алкен имеет цис- и трансизомеры. Тогда точно не подходят этен и пропен. Остается бутен-2: только он имеет цис- и трансизомеры.
Ответ . Бутен-2.
Задание 6. Принитровании одного из гомологов бензола массой 31,8 г было получено только одно мононитропроизводное массой 45,3 г. Установите строение исходного вещества продукта реакции.
Решение
По условию задачи (С 6 Н 5 R) = (С 6 Н 4 RNO 2). Используя формулу = m /M , получим:
31,8/(77 + R) = 45,3/(77 – 1 + 46 + R).
Отсюда R = 29.
Поскольку R = С n H 2n +1 , верно соотношение:
12n + 2n + 1 = 29.
Поэтому n = 2, радикал R – это С 2 Н 5 .
Однако по условию задачи получается только одно нитропроизводное. Следовательно, исходное вещество не может быть этилбензолом, т. к. тогда образовались бы орто- и паранитропроизводные. Значит, гомолог бензола содержит не радикал этил, а два метильных радикала. Расположены они симметрично (пара -ксилол). При таком расположении заместителей получается только одно нитропроизводное.
Уравнение реакции:

Задание 7. При нагревании смеси двух предельных первичных спиртов с разветвленным скелетом в присутствии серной кислоты получена смесь трех органических веществ, относящихся к одному классу соединений. Вещества получены в равных молярных соотношениях общей массой 21,6 г, при этом выделилась вода массой 2,7 г. Установите все возможные формулы исходных соединений и рассчитайте массу исходной смеси.
Решение
Анализируем условие задачи для написания уравнения. В присутствии серной кислоты возможна либо внутримолекулярная, либо межмолекулярная дегидратация или их комбинация. Если дегидратация внутримолекулярная, то получается всего два непредельных углеводорода, если межмолекулярная, то получается смесь трех эфиров. Комбинированный вариант рассматривать не имеет смысла, т.к. по условию получаются вещества одного класса. Уравнение реакции:

Рассчитаем количество вещества воды:
(H 2 O) = m /M = 2,7/18 = 0,15 моль.
Поскольку продукты реакции получены в равных молярных соотношениях, значит, каждого эфира получилось по: 0,15/3 = 0,05 моль.
Составляем уравнение материального баланса:
0,05 (М (R) + (М (R") + 16) + 0,05 (2М (R) + 16) + 0,05 (2М (R") + 16) = 21,6
Отсюда (M (R) + M (R") = 128. Оба радикала R и R" – предельные, поэтому их суммарную молярную массу можно записать так:
M (С n H 2n +1) = 128.
Подставляя значения атомных масс, находим:
12n + 2n + 1 = 128, n = 9.
Молекулы двух спиртов содержат 9 атомов углерода.
По условию задачи спирты первичные и имеют разветвленный углеродный скелет. Значит, один спирт содержит 4 атома углерода, а другой – 5.
Варианты формул:

Масса исходной смеси: 21,6 + 2,7 = 24,3 г.
Раздел 3.
Идентификация органических веществ
(качественные реакции на разные классы
соединений)
Занятие 7. Распознавание
органических веществ
с помощью качественных реакций
Ц е л и. Научить решать задачи на определение веществ, закрепить знания качественных реакций органических соединений разных классов.
Задание 1.
В четырех пробирках
находятся следующие вещества: гексан,
2-метилпентен-1,
пентин-2, пентин-1. При помощи каких химических
реакций можно различить эти вещества?
Решение
В этой задаче представлены три класса соединений: алканы, алкены и алкины. Для алканов нет особенных качественных реакций, для алкенов – это обесцвечивание бромной воды и раствора перманганата калия. Для алкинов тоже характерно обесцвечивание бромной воды и перманганата калия, но реакция идет медленнее (табл. 1). Предложенные два алкина отличаются положением тройной связи. Алкины, у которых тройная связь с края, реагируют с аммиачным раствором оксида серебра и оксида меди(I).
Таблица 1
| № пробирки | Реагенты | Вывод –
вещество в пробирке |
||
| OH | Br 2 (в H 2 O) | KMnO 4 (р-р) | ||
| 1 | – | – | – | Гексан |
| 2 | – | Быстрое обесцвечивание | Быстрое обесцвечивание | 2-Метилпентен-1 |
| 3 | – | Медленное обесцвечивание | Медленное обесцвечивание | Пентин-2 |
| 4 | Осадок | Медленное обесцвечивание | Медленное обесцвечивание | Пентин-1 |
Сначала проводят реакцию на обнаружение пентина-1:
CH 3 CH 2 CH 2 СCH + OH CH 3 CH 2 CH 2 СCAg + 2NH 3 + H 2 O.
Затем по отсутствию реакции с бромной водой обнаруживают гексан:
CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 + Br 2 (H 2 O) … .
Пентин-2 обесцвечивает бромную воду медленно, а 2-метилпентен-2 – быстро:

Реакцию с перманганатом калия можно не делать.
Задание 2. В трех пробирках без надписей находятся жидкости: н -пропанол, 1-хлорбутан и глицерин. Различите эти вещества.
Решение
В пробирках находятся вещества трех классов: спирт, многоатомный спирт и галогенпроизводное алканов. Глицерин обладает вязкостью, уже поэтому можно предположить, в какой он пробирке. Качественная реакция на многоатомные спирты – взаимодействие с гидроксидом меди(II) до василькового окрашивания. Спирт от галогеналкана можно отличить по реакции с натрием без нагревания. В пробирке со спиртом будет наблюдаться выделение пузырьков газа водорода (табл. 2).
Таблица 2
| № пробирки | Реагент | Вывод –
вещество в пробирке |
||
| По внешнему виду | Cu(OH) 2 | Na | ||
| 1 | Обладает вязкостью | Васильковое окрашивание | Выделение пузырьков газа | Глицерин |
| 2 | – | – | Выделение пузырьков газа | Пропанол |
| 3 | – | – | – | 1-Хлорбутан |
Уравнения реакций:


Задание 3. В трех пробирках налиты следующие жидкости: бензол, стирол, фенилацетилен. Определите, где какое вещество.
Решение
Все вещества содержат ароматическое кольцо:

Уравнения реакций:

Составим таблицу (табл. 3).
Таблица 3
| № пробирки | Реагент | Вывод – вещество в пробирке | |
| OH | Br 2 (в H 2 O) | ||
| 1 | – | – | С 6 Н 6 , бензол |
| 2 | – | Обесцвечивание бромной воды | С 6 Н 5 CH=CH 2 , стирол |
| 3 | Выпадение осадка | Обесцвечивание бромной воды | С 6 Н 5 CCH, фенилацетилен |
Задание 4. В трех пробирках без подписей находятся следующие вещества: бутанол-1, этиленгликоль, раствор фенола в бензоле. С помощью каких реакций можно различить эти вещества?
Решение
Составим таблицу (табл. 4).
Таблица 4
Уравнения реакций:


З а д а н и я д л я с а м о с т о я т е л ь н о г о р е ш е н и я
Задание 1. В четырех склянках без надписей находятся следующие органические вещества: этанол, ацетальдегид, этиленгликоль и водный раствор фенола. Предложите способ, как различить эти вещества.
Составим таблицу – схему решения (табл. 5).
Таблица 5
| № пробирки | Реагенты | Вывод – вещество в склянке | ||
| Cu(OH) 2 | Br 2 (в H 2 O) | OH | ||
| 1 | – | – | – | Этанол |
| 2 | – | – | Осадок | Ацетальдегид |
| 3 | Васильковое окрашивание | – | – | Этиленгликоль |
| 4 | – | Осадок | – | Фенол (в Н 2 О) |
Задание 2. В четырех пробирках находятся следующие вещества: муравьиная кислота, пропионовая кислота, метанол, уксусный альдегид. С помощью каких реакций можно различить названные вещества? Составьте уравнения этих реакций.
Составим таблицу – схему решения (табл. 6).
Таблица 6
| № пробирки | Реагенты | Вывод – вещество в пробирке | |
| Лакмус | OH | ||
| 1 | Красный | Осадок | Муравьиная кислота |
| 2 | Красный | – | Пропионовая кислота |
| 3 | Фиолетовый | – | Метанол |
| 4 | Фиолетовый | Осадок | Уксусный альдегид |
Задание 3. Напишите уравнения реакций, при помощи которых можно различить следующие твердые органические вещества: глюкозу, сахарозу, ацетат натрия, крахмал и фенол.
Составим таблицу – схему решения (табл. 7).
Таблица 7
| № пробирки | Реагенты | ||||
| Растворимость в холодной воде |
Cu(OH) 2 | Раствор йода | |||
| 1 | Растворим | Васильковое окрашивание | Изменение цвета на морковный | Опыт не проводим | Глюкоза |
| 2 | Растворим | Васильковое окрашивание | Практически без изменений | Опыт не проводим | Сахароза |
| 3 | Растворим | Без изменений | Без изменений | Без изменений | Ацетат натрия |
| 4 | Нерастворим | Опыт не проводим | Опыт не проводим | Синее окрашивание | Крахмал |
| 5 | Малорастворим | Опыт не проводим | Опыт не проводим | Без изменений | Фенол |
Реакцию с раствором бромной воды для определения фенола можно не проводить. Неопознанными остались два вещества – это ацетат натрия и фенол. Причем ацетат натрия хорошо растворим в холодной воде, а фенол – плохо. Так их можно различить.
Задание 4. Как различить органические вещества: хлорид фениламмония, ацетат натрия, глюкозу, аминоуксусную кислоту? Напишите уравнения реакций, которые надо осуществить для распознавания веществ.
Составим таблицу – схему решения (табл. 8).
Таблица 8
| № пробирки | Реагенты | Вывод – определяемое вещество | ||
| Cu(OH) 2 | Отношение к нагреванию растворов с васильковым окрашиванием | NaOH (тв.) при нагревании | ||
| 1 | Без изменений | Без изменений | Выделение газа, запах аммиака | Хлорид фениламмония |
| 2 | Без изменений | Без изменений | Выделение газа метана | Ацетат натрия |
| 3 | Васильковое окрашивание | Изменение цвета на морковный | Нет видимых изменений | Глюкоза |
| 4 | Темно-синее окрашивание | Без изменений | Нет видимых изменений | Аминоуксусная кислота |
Продолжение следует
Вещества и тела относятся к материальной составляющей действительности. И у тех и у других есть свои признаки. Рассмотрим, чем отличается вещество от тела.
Определение
Веществом называют материю, обладающую массой (в отличие, к примеру, от электромагнитного поля) и имеющую структуру из множества частиц. Есть вещества, состоящие из самостоятельных атомов, как, например, алюминий. Чаще атомы объединяются в более или менее сложные молекулы. Таким молекулярным веществом является полиэтилен.
Тело – отдельный, имеющий собственные границы материальный объект, занимающий собой часть окружающего пространства. Постоянными характеристиками подобного объекта считаются масса и объем. Тела также имеют конкретные размеры и форму, из которых складывается определенный визуальный образ предметов. Тела могут уже существовать в природе или быть результатом творчества человека. Примеры тел: книга, яблоко, ваза.
Сравнение
В целом отличие вещества от тела состоит в следующем: вещество – это то, из чего созданы существующие объекты (внутренний аспект материи), а сами эти объекты являются телами (внешний аспект материи). Так, парафин – вещество, а свеча из него – тело. Надо сказать, что тело – не единственное состояние, в котором могут пребывать вещества.
Любое вещество обладает совокупностью специфических свойств, благодаря которым его можно выделить из ряда других веществ. К таким свойствам относятся, например, особенности кристаллической структуры или степень нагрева, при которой происходит плавление.
Смешивая имеющиеся компоненты, можно получать совсем другие вещества, обладающие своим неповторимым набором свойств. Существует много веществ, созданных людьми на основе тех, что имеются в природе. Такими искусственными продуктами являются, к примеру, капрон и сода. Вещества, из которых что-то изготавливается людьми, называют материалами.
В чем разница между веществом и телом? Вещество всегда однородно по своему составу, то есть все молекулы или другие отдельные частицы в нем одинаковы. В то же время тело не всегда характеризуется однородностью. Например, банка, изготовленная из стекла, является однородным телом, а лопата для копки – неоднородным, поскольку ее верхняя и нижняя части выполняются из разных материалов.
Из некоторых веществ можно изготавливать множество разнообразных тел. Например, из резины делают мячи, автомобильные покрышки, коврики. Вместе с тем тела, выполняющие одну и ту же функцию, могут быть изготовлены из разных веществ, как, скажем, алюминиевая и деревянная ложки.
Тела, вещества, частицы
Любой предмет, любое живое существо можно назвать телом. Камень, кусок сахара, дерево, птица, проволока - это тела. Перечислить все тела невозможно, их существует бесчисленное множество. Солнце, планеты, Луна тоже тела. Их называют небесными телами.
Тела можно разделить
на две группы.
Тела, созданные
самой природой, называются естественные тела
.
Тела, созданные руками человека, называются искусственные
тела
.
Рассмотри рисунки. Под естественными телами закрась кружочки зелёным цветом, под искусственными - коричневым.

Тела состоят из веществ . Кусок сахара - тело, а сам сахар - вещество. Алюминиевая проволока - тело, алюминий - вещество. Есть тела, которые образованы не одним, а несколькими или многими веществами.
Вещества - это то, из чего состоят тела.
Различают
твёрдые, жидкие и газообразные вещества
.
Сахар, алюминий - примеры твёрдых веществ. Вода - жидкое вещество.
Воздух состоит из нескольких газообразных веществ (газов).
Запиши, из какого вещества сделано тело.

Какое тело имеет
определённую форму?
Ответ: Твердые тела имеют постоянную форму.
Заполни таблицу
Алюминий, серебро, тетрадь, древесина, телевизор, чайник, вода, пила, шкаф, крахмал.
Вещества,
а значит и тела состоят из частиц.
Каждое вещество состоит из особых частиц, которые по размерам и
форме отличаются от частиц других веществ.
Учёные установили, что между частицами есть промежутки. В твёрдых
веществах эти промежутки совсем маленькие, в жидких побольше, а
в газах еще больше. В любом веществе все частицы движутся.
Частицы можно изобразить с помощью моделей, например шариков.

Основной вопрос, на который должен знать ответ человек для правильного понимания картины мира - что такое вещество в химии. Данное понятие формируется ещё в школьном возрасте и направляет ребёнка в дальнейшем развитии. Приступая к изучению химии важно найти точки соприкосновения с ней на бытовом уровне, это позволяет наглядно и доступно разъяснить те или иные процессы, определения, свойства и т.д.
К сожалению, в силу неидеальности системы образования, многие упускают некоторые фундаментальные азы. Понятие «вещество в химии» - это своего рода краеугольный камень, своевременное усвоение данного определения даёт человеку правильный старт в последующем развитии в области естествознания.
Формирование понятия
Перед тем как перейти к понятию вещества, необходимо определить, чем является предмет химии. Вещества - это то, что непосредственно изучает химия, их взаимные превращения, строение и свойства. В общем понимании вещество - это то, из чего состоят физические тела.
Итак, в химии? Сформируем определение путём перехода от общего понятия к чисто химическому. Вещество - это определённый обязательно имеющий массу, которую можно измерить. Данная характеристика отличает вещество от другого вида материи - поля, которое массы не имеет (электрическое, магнитное, биополе и т.д.). Материя, в свою очередь, - это то, из чего созданы мы и всё, что нас окружает.
Несколько другая характеристика материи, определяющая то, из чего конкретно она состоит - это уже предмет химии. Вещества сформированы атомами и молекулами (некоторые ионами), а значит любая субстанция, состоящая из этих формульных единиц, и есть вещество.
Простые и сложные вещества
После усвоения базового определения можно перейти к его усложнению. Вещества бывают различных уровней организации, то есть простые и сложные (или соединения) - это самое первое деление на классы веществ, химия имеет множество последующих разделений, подробных и более сложных. Эта классификация, в отличие от многих других, имеет строго определённые границы, каждое соединение можно чётко отнести к одному из видов, взаимоисключающих друг друга.

Простое вещество в химии - это соединение, состоящее из атомов только одного элемента из периодической таблицы Менделеева. Как правило, это бинарные молекулы, то есть состоящие из двух частиц, соединённых посредством ковалентной неполярной связи - образования общей неподелённой электронной пары. Так, атомы одного и того же химического элемента имеют идентичную электроотрицательность, то есть способность удерживать общую электронную плотность, поэтому она не смещена ни к одному из участников связи. Примеры простых веществ (неметаллы) - водород и кислород, хлор, йод, фтор, азот, сера и т.д. Из трёх атомов состоит молекула такого вещества, как озон, а из одного - всех благородных газов (аргона, ксенона, гелия и т.д.). В металлах (магнии, кальции, меди т.д.) существует свой собственный тип связи - металлический, осуществляющийся за счёт обобществления свободных электронов внутри металла, а образования молекул как таковых не наблюдается. При записи вещества металла указывается просто символ химического элемента без каких-либо индексов.
Простое вещество в химии, примеры которого были приведены выше, отличается от сложного качественным составом. Химические соединения образованы атомами разных элементов, от двух и более. В таких веществах имеет место ковалентный полярный или ионный тип связывания. Так как разные атомы имеют отличающуюся электроотрицательность, то при образовании общей электронной пары происходит её сдвиг в сторону более электроотрицательного элемента, что приводит к общей поляризации молекулы. Ионный тип - это крайний случай полярного, когда пара электронов полностью переходит к одному из участников связывания, тогда атомы (или их группы) превращаются в ионы. Чёткой границы, между этими типами нет, ионную связь можно интерпретировать как ковалентную сильно полярную. Примеры сложных веществ - вода, песок, стекло, соли, оксиды и т.д.

Модификации веществ
Вещества, именуемые простыми, на самом деле имеют уникальную особенность, которая не присуща сложным. Некоторые химические элементы могут образовывать несколько форм простого вещества. В основе всё так же лежит один элемент, но количественный состав, строение и свойства кардинально отличают такие образования. Эта особенность имеет название аллотропии.
Кислород, сера, углерод и другие элементы имеют несколько Для кислорода - это О 2 и О 3 , углерод даёт четыре типа веществ - карбин, алмаз, графит и фуллерены, молекула серы бывает ромбической, моноклинной и пластической модификации. Такое простое вещество в химии, примеры которого не ограничены вышеперечисленными, имеет огромное значение. В частности, фуллерены используются как полупроводники в технике, фоторезисторы, добавки для роста алмазных плёнок и в других целях, а в медицине это мощнейшие антиоксиданты.
Что происходит с веществами?
Каждую секунду внутри и вокруг происходит превращение веществ. Химия рассматривает и объясняет те процессы, которые идут с качественным и/или количественным изменением состава реагирующих молекул. Параллельно, часто взаимосвязано протекают и физические превращения, которые характеризуются лишь изменением формы, цвета веществ или агрегатного состояния и некоторых других характеристик.

Химические явления - это реакции взаимодействия различных видов, например, соединения, замещения, обмена, разложения, обратимые, экзотермические, окислительно-восстановительные и т.д., в зависимости от изменения интересующего параметра. К относят: испарение, конденсацию, сублимацию, растворение, замерзание, электропроводимость и т.д. Часто они сопровождают друг друга, например, молния во время грозы - это физический процесс, а выделение под её действием озона - химический.
Физические свойства
Вещество в химии - это материя, которой присущи определённые физические свойства. По их наличию, отсутствию, степени и интенсивности можно спрогнозировать, как вещество поведёт себя в тех или иных условиях, а также объяснить некоторые химические особенности соединений. Так, например, высокие температуры кипения органических соединений, в которых есть водород и электроотрицательный гетероатом (азот, кислород и т.д.), свидетельствуют о том, что в веществе проявляется такой химический тип взаимодействия, как водородная связь. Благодаря знанию о том, какие вещества имеют наилучшую способность проводить электрический ток, кабеля и провода электропроводки изготавливаются именно из определённых металлов.

Химические свойства
Установлением, исследованием и изучением другой стороны медали свойств занимается химия. с её точки зрения - это их реакционная способность к взаимодействию. Некоторые вещества крайне активны в этом смысле, например, металлы или любые окислители, а другие, благородные (инертные) газы, при нормальных условиях в реакции практически не вступают. Химические свойства можно активировать или пассивировать при необходимости, иногда это не связано с особыми трудностями, а в некоторых случаях приходится нелегко. Учёные проводят многие часы в лабораториях, методом проб и ошибок добиваясь поставленных целей, иногда и не достигают их. Изменяя параметры окружающей среды (температуру, давление и т.д.) или применяя специальные соединения - катализаторы или ингибиторы - можно повлиять на химические свойства веществ, а значит и на ход реакции.
Классификация химических веществ
В основе всех классификаций лежит разделение соединений на органические и неорганические. Главный элемент органики - это углерод, соединяясь друг с другом и гидрогеном, атомы карбона образуют углеводородный скелет, который после заполняется другими атомами (кислородом, азотом, фосфором, серой, галогенами, металлами и другими), замыкается в циклы или разветвляется, обосновывая тем самым большое разнообразие органических соединений. На сегодняшний день науке известны 20 миллионов таких веществ. В то время как минеральных соединений всего лишь полмиллиона.

Каждое соединение индивидуально, но имеет и множество похожих черт с другими в свойствах, строении и составе, на этой основе происходит группировка в классы веществ. Химия имеет высокий уровень систематизации и организации, это точная наука.
Неорганические вещества
1. Оксиды - бинарные соединения с кислородом:
а) кислотные - при взаимодействии с водой дают кислоту;
б) основные - при взаимодействии с водой дают основание.
2. Кислоты - вещества, состоящие из одного или нескольких протонов водорода и кислотного остатка.
3. Основания (щёлочи) - состоят из одной или нескольких гидроксильных групп и атома металла:
а) амфотерные гидроксиды - проявляют свойства и кислот и оснований.
4. Соли - результат между кислотой и щелочью (растворимым основанием), состоят из атома металла и одного или нескольких кислотных остатков:
а) кислые соли - анион кислотного остатка имеет в составе протон, результат неполной диссоциации кислоты;
б) основные соли - с металлом связана гидроксильная группа, результат неполной диссоциации основания.

Органические соединения
Классов веществ в органике великое множество, такой объём информации сложно сразу запомнить. Главное, знать основные разделения на алифатические и циклические соединения, карбоциклические и гетероциклические, предельные и непредельные. Также углеводороды имеют множество производных, в которых атом гидрогена замещён на галоген, кислород, азот и другие атомы, а так же функциональные группы.
Вещество в химии - это основа сущестования. Благодаря органическому синтезу человек на сегодняшний день имеет огромное количество искусственных веществ, заменяющих натуральные, а также не имеющих аналогов по своим характеристикам в природе.
Молекулярные вещества - это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода H 2 O - жидкость, t пл = 0°С; t кип = 100°С; Кислород O 2 - газ, t пл = -219°С; t кип = -183°С; Оксид азота (V) N 2 O 5 - твердое вещество, t пл = 30,3°С; t кип = 45°С;
К молекулярным веществам относятся:
большинство простых веществ неметаллов: O 2 , S 8 , P 4 , H 2 , N 2 , Cl 2 , F 2 , Br 2 , I 2 ;
соединения неметаллов друг с другом (бинарные и многоэлементные): NH 3 , CO 2 , H 2 SO 4 .
Немолекулярные вещества
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион - это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na + , Cl - .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например: натрий хлорид NaCl - твердое вещество, t пл = 801°С; t кип = 1465°С; медь Cu - твердое вещество, t пл = 1083°С; t кип = 2573°С; кремний Si - твердое вещество, t пл = 1420°С; t кип = 3250°С;
К немолекулярным веществам относятся:
простые вещества (металлы): Na, Cu, Fe, …;
сплавы и соединения металлов с неметаллами: NaH, Na 2 SO 4 , CuCl 2 , Fe 2 O 3 ;
неметаллы: бор, кремний, углерод (алмаз), фосфор (чёрный и красный);
некоторые бинарные соединения неметаллов: SiC, SiO 2 .